***
Od ponad trzydziestu lat jestem z mikrobiologią za pan brat, realizuję swoje marzenia z pasją, pracując w medycznym laboratorium mikrobiologicznym. Blog jest kompilacją własnego doświadczenia zdobytego w pracy, wiedzy zdobytej na studiach, szkoleniach, literatury naukowej oraz materiałów dostępnych w Internecie.
Pokazywanie postów oznaczonych etykietą Diagnostyka Mikrobiologiczna. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą Diagnostyka Mikrobiologiczna. Pokaż wszystkie posty
niedziela, 17 lipca 2016
piątek, 7 marca 2014
Pseudomonas aeruginosa w owrzodzonej ranie palca stopy
Czynnikiem etiologicznym odpowiedzialnym za dużą, owrzodzoną ranę na palcu stopy okazała się pałeczka ropy błękitnej Pseudomonas aeruginosa. Owrzodzenie palca utrzymuje się u pacjentki od co najmniej roku.
.jpg) |
| Pseudomonas aeruginosa na Columbia Agar |
.jpg) |
| Pseudomonas aeruginosa na Columbia Agar |
Lekooporność pał. Pseudomonas aeruginosa na podłożu M-H
.jpg) |
| Pseudomonas aeruginosa na podłożu chromogennym |
Linki dot. Pseudomonas aeruginosa
Zielone paznokcie. Pseudomonas aeruginosa
sobota, 30 listopada 2013
Diagnostyka mikrobiologiczna - wykład prof. Waleria Hryniewicz
Materiał audiowizualny MP
prof. Waleria Hryniewicz
czwartek, 15 listopada 2012
Gardnerella vaginalis w gardle?
Miałam poważne wątpliwości czy wyhodowane paciorkowce uznać za Gardnerella vaginalis. W końcu to bakterie mające powinowactwo do nabłonka dróg moczowo-płciowych, a ja badałam wymaz z gardła.
Postanowiłam jednak przed wypisaniem wyniku skonsultować się z pacjentką, by wyjaśnić moje wątpliwości.
Pacjentka bez namysłu stwierdziła, że to może być całkiem prawdopodobne, ze względu na seks oralny. Pewnie dlatego mają razem z partnerem ciągłe kłopoty zdrowotne i dyskomfort podczas współżycia. Krosty, zaczerwienienie, swędzenie, w okolicach intymnych, nieustający ból gardła, nieskuteczność antybiotyków i in. chemioterapeutyków. Obwiniała się, że to pewnie ona systematycznie zaraża swojego partnera.
Badając materiał od tej pacjentki, chyba intuicyjnie nastawiłam krążek GV, bo rutynowo nigdy tego nie robię i chyba żaden mikrobiolog nie szuka rutynowo Gardnerella vaginalis w materiale z gardła.
Postanowiłam jednak przed wypisaniem wyniku skonsultować się z pacjentką, by wyjaśnić moje wątpliwości.
Pacjentka bez namysłu stwierdziła, że to może być całkiem prawdopodobne, ze względu na seks oralny. Pewnie dlatego mają razem z partnerem ciągłe kłopoty zdrowotne i dyskomfort podczas współżycia. Krosty, zaczerwienienie, swędzenie, w okolicach intymnych, nieustający ból gardła, nieskuteczność antybiotyków i in. chemioterapeutyków. Obwiniała się, że to pewnie ona systematycznie zaraża swojego partnera.
Badając materiał od tej pacjentki, chyba intuicyjnie nastawiłam krążek GV, bo rutynowo nigdy tego nie robię i chyba żaden mikrobiolog nie szuka rutynowo Gardnerella vaginalis w materiale z gardła.
Wymieniane przez pacjentkę objawy - krosty, zaczerwienienie, swędzenie, nieustający ból gardła, nieskuteczność antybiotyków są spowodowane raczej grzybicą, bo w badanym materiale wyhodowano również blastospory grzybów drożdżopodobnych z rodz. Candida.
Antymykogram wskazuje na możliwość leczenia tej kandydozy za pomocą ketokonazolu, ekonazolu, klotrymazolu lub flukonazolu. Pacjentka dostała co prawda flukonazol, ale w czopkach czy globulkach. Terapia samymi globulkami nie ma sensu, jeśli równocześnie nie leczy się partnera. Należy pamiętać również o grzybach, które skolonizowały jamę ustną, które przez wielu lekarzy uznawane są za florę fizjologiczną.
 |
| Hodowla drobnoustrojów w warunkach tlenowych na agarze z krwią baranią. Wymaz z gardła |
U aktywnych seksualnie kobiet i mężczyzn różne grupy drobnoustrojów, od bakterii, po wirusy czy pierwotniaki mogą być przyczyną przewlekłych infekcji jamy ustnej i narządów płciowych równocześnie.
Groźnymi patogenami przenoszonymi na drodze kontaktu płciowego są m. in. kiła, rzeżączka, chlamydia, rzęsistek pochwowy, wirus opryszczki, wirus brodawczaka ludzkiego, Gardnerella vaginalis, Streptococcus agalactiae, Candida spp. i jeszcze kilka innych.
Kiedyś, jednostki chorobowe wywoływane kiłą czy rzeżączką kwalifikowano jako choroby wenerycznymi, dzisiaj mówimy, że są to choroby przenoszone drogą płciową. Bakteryjna waginoza wywoływana przez Gardnerella vaginalis nie jest uważana za chorobę przenoszoną drogą płciową.
Krążek diagnostyczny GV nasycony bacytracyną służy do identyfikacji
środa, 17 października 2012
Yersinia
Do rodzaju Yersinia zaliczamy obecnie 12 gatunków: Y. pestis, Y. pseudotuberculosis, Y. enterocolitica, Y. fredreksenii, Y. intermedia, Y. kristensenii, Y. bercovieri, Y. mollaterii, Y. rohdel, Y. ruckeri, Y. aldovae, oraz sklasyfikowany w 2005 roku Y. aleksiciae.
Rodzaj Yersinia został wyodrębniony w ramach rodziny Enterobacteriaceae w 1964 roku i liczył trzy gatunki: Y. pestis, Y. pseudotuberculosis, Y. enterocolitica, wcześniej klasyfikowane do rodzaju Pasteurella.
Zmiany w taksonomii spowodowane zostały wprowadzeniem do identyfikacji metod taksonomii numerycznej oraz metod molekularnych.
W stosunku do dziewięciu gatunków: Y. fredreksenii, Y. kristensenii, Y. bercovieri, Y. mollaterii, Y. rohdel, Y. ruckeri, Y. aldovae, Y. intermedia i Y. aleksiciae, używa się określenia „podobne do Y. enterocolitica”, czyli „Y. enterocolitica – like”.
Większość z tych gatunków wcześniej należała do biotypów Y. enterocolitica. Gatunki te opisuje się czasami jako niepatogenne, gdyż pozbawione są czynników wirulencji charakterystycznych dla wysokozjadliwych szczepów Yersinia.
Większość z tych gatunków wcześniej należała do biotypów Y. enterocolitica. Gatunki te opisuje się czasami jako niepatogenne, gdyż pozbawione są czynników wirulencji charakterystycznych dla wysokozjadliwych szczepów Yersinia.
Pałeczki Yersinia są wewnątrzkomórkowymi pasożytami, których chorobotwórczość
związana jest z właściwościami inwazyjnymi, zdolnością do rozmnażania się w organizmie gospodarza oraz wytwarzaniem toksyn.
związana jest z właściwościami inwazyjnymi, zdolnością do rozmnażania się w organizmie gospodarza oraz wytwarzaniem toksyn.
Y. enterocolitica – like są patogenne dla ssaków, ptaków, gadów, płazów i ryb oraz
szeroko rozpowszechnione w środowisku naturalnym. Jednakże, istnieją doniesienia o wywoływaniu przez te szczepy u ludzi biegunek i innych objawów chorobowych, za które odpowiadają odmienne czynniki zjadliwości. Ponieważ gatunki te występują u zwierząt, istnieje możliwość zakażeń odzwierzęcych. Nie można również wykluczyć możliwości przeniesienia szczepu z człowieka na człowieka.
szeroko rozpowszechnione w środowisku naturalnym. Jednakże, istnieją doniesienia o wywoływaniu przez te szczepy u ludzi biegunek i innych objawów chorobowych, za które odpowiadają odmienne czynniki zjadliwości. Ponieważ gatunki te występują u zwierząt, istnieje możliwość zakażeń odzwierzęcych. Nie można również wykluczyć możliwości przeniesienia szczepu z człowieka na człowieka.
Diagnostyka mikrobiologiczna pałeczek z rodzaju Yersinia wymaga zastosowania odpowiednich warunków temperaturowych, podłoży bakteriologicznych, surowic, testów serologicznych itp. Wyniki w dużej mierze zależały od stosowanych w laboratoriach testów identyfikacyjnych i tak, jak to ma miejsce w szerokospektralnej diagnostyce
mikrobiologicznej (nie tylko diagnostyka schorzeń przewodu pokarmowego) być może zaistnieje konieczność poszerzenia możliwości diagnostycznych o „nowe” czynniki etiologiczne zakażeń.
Szczepy, które były dawniej rozpatrywane biochemicznie jako atypowe izolaty Y. enterocolitica zostały reklasyfikowane, jako Y. intermedia, Y. frederiksenii i Y. kristensenii. Różnicowanie Y. enterocolitica od innych gatunków tego rodzaju odbywa się na podstawie fermentacji cukrów, dekarboksylacji ornityny i wytwarzania indolu.
I tak np.: Y. kristenseni nie fermentuje sacharozy natomiast dodatnie wyniki fermentacji sacharozy uzyskamy dla Y. enterocolitica.
Hodowla
· Wskazana temperatura inkubacji pałeczek Yersinia enterocolitica to 25°C, podłoże MC, CIN
· Każdorazowa izolacja Yersinia enterocolitica wymaga określenia potencjalnej zjadliwości szczepu
· Rekomendowane podłoże do wykrywania plazmidu wirulencji to CRMOX
· W przypadku izolacji szczepu potencjalnie zjadliwego wskazane jest przekazanie go do laboratorium referencyjnego
mikrobiologicznej (nie tylko diagnostyka schorzeń przewodu pokarmowego) być może zaistnieje konieczność poszerzenia możliwości diagnostycznych o „nowe” czynniki etiologiczne zakażeń.
Szczepy, które były dawniej rozpatrywane biochemicznie jako atypowe izolaty Y. enterocolitica zostały reklasyfikowane, jako Y. intermedia, Y. frederiksenii i Y. kristensenii. Różnicowanie Y. enterocolitica od innych gatunków tego rodzaju odbywa się na podstawie fermentacji cukrów, dekarboksylacji ornityny i wytwarzania indolu.
I tak np.: Y. kristenseni nie fermentuje sacharozy natomiast dodatnie wyniki fermentacji sacharozy uzyskamy dla Y. enterocolitica.
.jpg) |
| Różnicowanie biochemiczne Yersinia kristensenii |
Hodowla
· Wskazana temperatura inkubacji pałeczek Yersinia enterocolitica to 25°C, podłoże MC, CIN
· Każdorazowa izolacja Yersinia enterocolitica wymaga określenia potencjalnej zjadliwości szczepu
· Rekomendowane podłoże do wykrywania plazmidu wirulencji to CRMOX
· W przypadku izolacji szczepu potencjalnie zjadliwego wskazane jest przekazanie go do laboratorium referencyjnego
poniedziałek, 27 sierpnia 2012
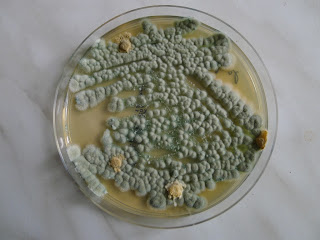
Grzyby pleśniowe w ciastkach
Udało mi sie wyhodować piękne grzyby pleśniowe. Z ciastek. Smakowicie i apetycznie wyglądających. Kupiłam nieduży kawałek w ciastkarni, z myślą, że poczęstuję koleżanki z pracy. Niestety, ciasto miało posmak pleśni. Wygrzebałam z masy kremowej kawałki zielonych farfocli. Posiałam je na stosowne pożywki i już po kilku dniach uzyskałam piękną zieloną hodowlę grzybów.
Wiadomo, że toksyczne metabolity grzybów pleśniowych, a poznano ich już ponad 400, mają działanie rakotwórcze, toksynotwórcze, uszkadzają zastawki serca, wątrobę, nerki oraz wywołują masę innych zagrożeń zdrowotnych.
Te związki to mykotoksyny, a największa liczba znanych mykotoksyn jest produkowana przez gatunki należące do rodzajów Aspergillus, Penicillium, Fusarium i Alternaria. Najbardziej znane mykotoksyny i najbardziej groźne dla zdrowia są aflatoksyna B, ochratoksyna A, gryzeofulwina czy opisywana w oddzielnym blogu patulina.
Te związki to mykotoksyny, a największa liczba znanych mykotoksyn jest produkowana przez gatunki należące do rodzajów Aspergillus, Penicillium, Fusarium i Alternaria. Najbardziej znane mykotoksyny i najbardziej groźne dla zdrowia są aflatoksyna B, ochratoksyna A, gryzeofulwina czy opisywana w oddzielnym blogu patulina.
Ja kupiłam tylko niewielki kawałek ciasta tortowego. Pewnie niejedna osoba nawet nie poczuła zmienionego smaku popełniając grzech łakomstwa.
Może od razu nie umrzemy, jeśli zjemy kawałek takiego zepsutego ciasta, ale biada obżartuchom, którzy codziennie przechodząc obok ciastkarni, nie mogą się oprzeć pokusie apetycznie wyglądających słodkości. Na pozór apetycznie.
piątek, 20 lipca 2012
Szkło kontaktowe, ameby i parachlamydie
Czy wiesz, że noszenie soczewek kontaktowych może być niebezpiecznie? Istnieje zagrożenie zdrowia, gdyż badania naukowe donoszą o tworzeniu na szkłach biofilmu zawierającego chorobotwórcze chlamydie. Rola biofilmu w patogenezie człowieka
Chlamydie to grupa zarazków stanowiących duże zagrożenie dla zdrowia człowieka. Choroby wywoływane przez te drobnoustroje np. jaglica (trachoma) znane były już w starożytności, nawet kilka tysięcy lat temu. Na początku XX wieku wykazano związek miedzy schorzeniami narządów moczowo-płciowych kobiet, a zapaleniem spojówek u noworodków. W latach 70. XX wieku udało się już izolować zarazki w hodowli komórkowej. Kolejne badania przez kolejne lata pozwalały poszerzać wiedzę na temat cyklu rozwojowego, unikalnego dla tego rodzaju bakterii, zróżnicowania serotypowego, chorobotwórczości, wrażliwości na antybiotyki.
Istnieją doniesienia, że nie tylko dotychczas znane i opisywane 4 gatunki należące do rodzaju Chlamydia (Ch. trachomatis, Ch. psittaci, Ch. pecorum i Ch. pneumoniae) są odpowiedzialne jako patogeny dla człowieka. Dzięki nowoczesnym metodom badawczym w biologii molekularnej, głównie metodyce PCR udało sie wykryć nowe gatunki chlamydii, które mają swój udział w patogenezie chorób człowieka.
Chlamydia środowiskowe, należące do 7 rodzin są również chorobotwórcze i to nie tylko dla zwierząt, ale i dla człowieka. (patrz niżej podział systematyczny na 8 rodzin).
Parachlamydie należące do rodziny Parachlamydiaceae pierwotnie były izolowane głównie u ameb, ryb i owadów, prawdopodobnie jednak mogą przebywać poza swoistym gospodarzem.
Badania wykazują, że parachlamydie są patogenne dla człowieka. W biofilmie występującym na szkłach kontaktowych wykryto ameby, a te są gospodarzem dla chlamydii.
Parachlamydie mogą wywoływać również zmiany na skórze, infekcje dróg oddechowych. Izolowano je też w płynie mózgowo-rdzeniowym u pacjentów chorych na stwardnienie rozsiane, w płytkach miażdżycowych u ludzi.
U kobiet zakażonych jednym z gatunków parachlamydii - Parachlamydia acanthamoebae, wykazano możliwość jej przechodzenia przez łożysko i prowokowanie przedwczesnych porodów.
Izolowano ten gatunek również w zapaleniu płuc, osierdzia, nerek i wątroby u gadów - węży, żółwi i jaszczurek), w poronionych płodach u bydła, owiec i kóz, a u kurcząt z zapaleniem spojówek, u kotów z zapaleniem rogówki, nekrozą i erozją rogówki.
Patomechanizm:
Ameby ulegają lizie w błonie śluzowej nosa, uwalniają się parachlamydie i zakażają komórki np. układu oddechowego. Parachlamydie mają zdolność przeżywania w ludzkich makrofagach i monocytach.
Systematyka chlamydii
W 1999r nastąpił przełom w badaniach nad systematyką chlamydii. Dotychczas systematyka obejmowała 1 rodzinę Chlamydiaceae w tym 4 gatunki (Ch. trachomatis, Ch. psittaci, Ch. pecorum i Ch. pneumoniae). Teraz ze względu na postęp badań molekularnych, głównie metodyki PCR, uporządkowano i usystematyzowano grupę tych patogennych dla człowieka i zwierząt bakterii.
I tak w Rzędzie Chlamydiales wyodrębniono 4 rodziny
1. Rodzina Clamydiaceae
2. Rodzina Parachlamydiaceae
3. Rodzina Simkaniaceae
4. Rodzina Waddliaceae.
Obecnie systematyka chlamydii obejmuje dodatkowo jeszcze kolejne 4 rodziny. Rodziny od 2- 7 stanowią grupę tzw. chlamydii środowiskowych.
5. Rodzina Rhabdochlamydiaceae
6. Rodzina Piscichlamydiaceae
7. Rodzina Clavochlamydiaceae
8. Rodzina Criblamydiceae.
Chlamydie środowiskowe występują w środowisku powszechnie, jako symbionty ameb, krewetek, ryb, owadów i ssaków. Wśród nich występują izolaty patogenne dla człowieka, ale też innych ssaków, jak koty, bydło, są chorobotwórcze tez dla gadów. Badania wskazują, że ta dotychczas mało znana grupa rodzin chlamydii środowiskowych w miarę postępu i rozwoju diagnostyki mikrobiologicznej może stanowić potencjalną grupę patogenów dla ssaków, w tym człowieka.
Literatura:
Choroby u ludzi spowodowane chlamydiami i chlamydofilami - Postepy Hig Med Dosw. (online), 2007; 61: 708-717
Chlamydie to grupa zarazków stanowiących duże zagrożenie dla zdrowia człowieka. Choroby wywoływane przez te drobnoustroje np. jaglica (trachoma) znane były już w starożytności, nawet kilka tysięcy lat temu. Na początku XX wieku wykazano związek miedzy schorzeniami narządów moczowo-płciowych kobiet, a zapaleniem spojówek u noworodków. W latach 70. XX wieku udało się już izolować zarazki w hodowli komórkowej. Kolejne badania przez kolejne lata pozwalały poszerzać wiedzę na temat cyklu rozwojowego, unikalnego dla tego rodzaju bakterii, zróżnicowania serotypowego, chorobotwórczości, wrażliwości na antybiotyki.
Istnieją doniesienia, że nie tylko dotychczas znane i opisywane 4 gatunki należące do rodzaju Chlamydia (Ch. trachomatis, Ch. psittaci, Ch. pecorum i Ch. pneumoniae) są odpowiedzialne jako patogeny dla człowieka. Dzięki nowoczesnym metodom badawczym w biologii molekularnej, głównie metodyce PCR udało sie wykryć nowe gatunki chlamydii, które mają swój udział w patogenezie chorób człowieka.
Chlamydia środowiskowe, należące do 7 rodzin są również chorobotwórcze i to nie tylko dla zwierząt, ale i dla człowieka. (patrz niżej podział systematyczny na 8 rodzin).
Parachlamydie należące do rodziny Parachlamydiaceae pierwotnie były izolowane głównie u ameb, ryb i owadów, prawdopodobnie jednak mogą przebywać poza swoistym gospodarzem.
Badania wykazują, że parachlamydie są patogenne dla człowieka. W biofilmie występującym na szkłach kontaktowych wykryto ameby, a te są gospodarzem dla chlamydii.
Parachlamydie mogą wywoływać również zmiany na skórze, infekcje dróg oddechowych. Izolowano je też w płynie mózgowo-rdzeniowym u pacjentów chorych na stwardnienie rozsiane, w płytkach miażdżycowych u ludzi.
U kobiet zakażonych jednym z gatunków parachlamydii - Parachlamydia acanthamoebae, wykazano możliwość jej przechodzenia przez łożysko i prowokowanie przedwczesnych porodów.
Izolowano ten gatunek również w zapaleniu płuc, osierdzia, nerek i wątroby u gadów - węży, żółwi i jaszczurek), w poronionych płodach u bydła, owiec i kóz, a u kurcząt z zapaleniem spojówek, u kotów z zapaleniem rogówki, nekrozą i erozją rogówki.
Patomechanizm:
Ameby ulegają lizie w błonie śluzowej nosa, uwalniają się parachlamydie i zakażają komórki np. układu oddechowego. Parachlamydie mają zdolność przeżywania w ludzkich makrofagach i monocytach.
Systematyka chlamydii
W 1999r nastąpił przełom w badaniach nad systematyką chlamydii. Dotychczas systematyka obejmowała 1 rodzinę Chlamydiaceae w tym 4 gatunki (Ch. trachomatis, Ch. psittaci, Ch. pecorum i Ch. pneumoniae). Teraz ze względu na postęp badań molekularnych, głównie metodyki PCR, uporządkowano i usystematyzowano grupę tych patogennych dla człowieka i zwierząt bakterii.
I tak w Rzędzie Chlamydiales wyodrębniono 4 rodziny
1. Rodzina Clamydiaceae
2. Rodzina Parachlamydiaceae
3. Rodzina Simkaniaceae
4. Rodzina Waddliaceae.
Obecnie systematyka chlamydii obejmuje dodatkowo jeszcze kolejne 4 rodziny. Rodziny od 2- 7 stanowią grupę tzw. chlamydii środowiskowych.
5. Rodzina Rhabdochlamydiaceae
6. Rodzina Piscichlamydiaceae
7. Rodzina Clavochlamydiaceae
8. Rodzina Criblamydiceae.
Chlamydie środowiskowe występują w środowisku powszechnie, jako symbionty ameb, krewetek, ryb, owadów i ssaków. Wśród nich występują izolaty patogenne dla człowieka, ale też innych ssaków, jak koty, bydło, są chorobotwórcze tez dla gadów. Badania wskazują, że ta dotychczas mało znana grupa rodzin chlamydii środowiskowych w miarę postępu i rozwoju diagnostyki mikrobiologicznej może stanowić potencjalną grupę patogenów dla ssaków, w tym człowieka.
Literatura:
Choroby u ludzi spowodowane chlamydiami i chlamydofilami - Postepy Hig Med Dosw. (online), 2007; 61: 708-717
Chlamydie środowiskowe - nowe dane - Postępy Mikrobiologii 2012, 2, 143-149
poniedziałek, 25 czerwca 2012
Trójkąt śmierci
Niezmiernie groźnym w skutkach jest wszelkiego rodzaju manipulacja
przy wypryskach, krostach, czyrakach w obrębie twarzy. Niedopuszczalne jest
wyduszanie ich zawartości. Istnieje bowiem niebezpieczeństwo groźnych powikłań
zdrowotnych, nie wspominając o efektach estetycznych w postaci trwale
pozostających na twarzy drobnych blizn czy dużych porów. Takie ropne krosty są szczególnie niebezpieczne w obrębie‘trójkąta śmierci’.
'Trójkąt śmierci" to termin kliniczny odnoszący
się do regionu anatomicznego twarzy zawartego pomiędzy kącikami ust i szczytem
piramidy nosa. W jego skład wchodzi warga górna i piramida nosa. Okolica ta ze
względu na specyficzne unaczynienie żylne jest szczególnie niebezpieczna w
przypadku stanów zapalnych toczących się w jej obrębie. Mogą one prowadzić do
groźnych powikłań wewnątrzczaszkowych, z których najgroźniejszym jest
zakrzepowe zapalenie zatoki jamistej w wyniku ognisk zapalnych okołozębowych,
zapaleń ucha środkowego, zatok klinowych, czołowych i sitowia oraz ropnia
przegrody.
Najczęstszą przyczyną ropnych krost pojawiających się na buzi są bakterie beztlenowe, jak i bakterie rosnące w warunkach tlenowych, głównie gronkowce złociste Staphylococcus aureus. Mogą występować równocześnie i jedne i drugie, a na dodatek jeszcze w towarzystwie grzybów. Wywołują zapalenie mieszka włosowego lub gruczołu łojowego czy potowego oraz otaczającej go skóry właściwej. Nie zawsze przyczyną jest brak dostatecznych nawyków higienicznych. Rozwojowi zakażenia sprzyjają: zaburzenia przemiany materii, zaburzenia hormonalne, zwłaszcza w okresie dojrzewania, utajone ogniska zakażenia np. chore zęby oraz urazy mechaniczne, chemiczne, a u osób wrażliwych podrażnienia spowodowane stosowaniem kosmetyków.
Początek choroby jest dość szybki. W ciągu kilku godzin narasta bolesny obrzęk zapalny, towarzyszy temu zazwyczaj wysoka gorączka. Na szczycie obrzęku powstaje ropna krosta, a wewnątrz czop tkanki martwiczej. Po jego wydzieleniu tworzy się owrzodzenie, które następnie ulega zabliźnieniu. W przypadku wczesnego rozpoznania i leczenia obrzęk może się cofnąć bez zropienia.
 Ważnym
jest, aby przed podjęciem leczenia wykonać posiew ropnej wydzieliny czyraka i określić
antybiogram w celu potwierdzenia ewentualnych zakażeń mieszanych, ustalenia
lekooporności drobnoustrojów, wykrycia mechanizmów oporności na antybiotyki i
chemioterapeutyki. Tych mechanizmów oporności jest kilka.
Ważnym
jest, aby przed podjęciem leczenia wykonać posiew ropnej wydzieliny czyraka i określić
antybiogram w celu potwierdzenia ewentualnych zakażeń mieszanych, ustalenia
lekooporności drobnoustrojów, wykrycia mechanizmów oporności na antybiotyki i
chemioterapeutyki. Tych mechanizmów oporności jest kilka.
Na zdjęciu przedstawiłam wrażliwość szczepu Staphylococcus aures wykazujący oporność indukowaną MLSB. Jest oporny na erytromycynę, wrażliwy na klinadanycynę. Po otrzymaniu antybiogramu terapia powinna ulec modyfikacji.
W przypadku szczepów opornych (S. aureus MRSA) lekami z wyboru są wankomycyna i teikoplanina.
 |
| Trójkąt śmierci - schemat * |
Najczęstszą przyczyną ropnych krost pojawiających się na buzi są bakterie beztlenowe, jak i bakterie rosnące w warunkach tlenowych, głównie gronkowce złociste Staphylococcus aureus. Mogą występować równocześnie i jedne i drugie, a na dodatek jeszcze w towarzystwie grzybów. Wywołują zapalenie mieszka włosowego lub gruczołu łojowego czy potowego oraz otaczającej go skóry właściwej. Nie zawsze przyczyną jest brak dostatecznych nawyków higienicznych. Rozwojowi zakażenia sprzyjają: zaburzenia przemiany materii, zaburzenia hormonalne, zwłaszcza w okresie dojrzewania, utajone ogniska zakażenia np. chore zęby oraz urazy mechaniczne, chemiczne, a u osób wrażliwych podrażnienia spowodowane stosowaniem kosmetyków.
Początek choroby jest dość szybki. W ciągu kilku godzin narasta bolesny obrzęk zapalny, towarzyszy temu zazwyczaj wysoka gorączka. Na szczycie obrzęku powstaje ropna krosta, a wewnątrz czop tkanki martwiczej. Po jego wydzieleniu tworzy się owrzodzenie, które następnie ulega zabliźnieniu. W przypadku wczesnego rozpoznania i leczenia obrzęk może się cofnąć bez zropienia.
Na zdjęciu przedstawiłam wrażliwość szczepu Staphylococcus aures wykazujący oporność indukowaną MLSB. Jest oporny na erytromycynę, wrażliwy na klinadanycynę. Po otrzymaniu antybiogramu terapia powinna ulec modyfikacji.
W przypadku szczepów opornych (S. aureus MRSA) lekami z wyboru są wankomycyna i teikoplanina.
Literatura:
* Lek. med.
Paweł Podogrodzki Katedra i Klinika Otolaryngologii A M w Warszawie Kierownik:
Prof. dr hab. med. Grzegorz Janczewski. Trójkąt śmierci (Triangle of death).środa, 13 czerwca 2012
Choroba kociego pazura (CSD)
Trzeba mieć na uwadze, że nasze milusińskie koty mogą roznosić bardzo groźne drobnoustroje chorobotwórcze wywołujące u człowieka zoonozy, choroby odzwierzęce o różnym przebiegu choroby, od łagodnych, bezobjawowych, przewlekłych, aż po zapalenie mózgu czy wsierdzia. Choroby odzwierzęce (zoonozy), gdzie patogenem są Bartonella spp. opisane zostały jeszcze w XIX wieku, ale dopiero dzięki postępowi w biologii molekularnej można było dokładniej poznać gatunki, jako czynnik etiologiczny, ich wektory, czyli przenosicieli (wszy, pchły i kleszcze), udoskonalić diagnostykę i skuteczną terapię.
Bartonella jest odpowiedzialna za największą liczbę przypadków bartonelloz występujących na całym świecie. Bartonella spp. to bakterie wewnątrzkomórkowe, wykazujące tropizm do erytrocytów oraz komórek nabłonka naczyń krwionośnych.
Rezerwuarem mogą być zwierzęta domowe oraz dzikie. Mogą być sarny, wiewiórki ziemne, kangury, kojoty, króliki, krety, psy oraz koty, szczególnie młode. Bakterie przenoszone są przez pchły, wszy i kleszcze, które żywią się krwią zakażonych ssaków i wykazują ścisłą preferencję dot. przenoszonego gatunku bakterii jak i rezerwuaru.
Podczas I wojny światowej odnotowano ok. 400 000 zachorowań na bartonellozę wśród wojsk Ententy i państw centralnych. Choroba wywołana przez Bartonella quintana zwana gorączką okopową dopadła żołnierzy ze względu na panującą wszawicę (głowową i odzieżową). Ten sam gatunek zaatakował żołnierzy niemieckich na froncie wschodnim w czasie II wojny światowej.
W latach 1940-45 odnotowano przypadki zakażeń laboratoryjnych u karmicieli wszy i pracowników w zakładach produkujących szczepionkę przeciw durowi plamistemu (Rickettsia prowazeki).
Przykładem zoonozy jest choroba kociego pazura z ang. zwaną CSD (cat scratch disease). Wywołują ją gatunki Bartonella henselae i Bartonella clarridgeide, 2 z 24 poznanych gatunków z rodzaju Bartonella należące do rzędu Rickettsiales. Wektorem Bartonella henselae i Bartonella clarridgeide są przede wszystkim pchły kocie. Kontakt z ich odchodami powoduje przeniesienie bakterii na inne zwierzęta, na uszkodzoną skórę człowieka powodując zakażenie. Podobnie zakażenie występuje przez ślinę psów zwłaszcza bezdomnych i kotów.
Choroba kociego pazura ma zazwyczaj przebieg łagodny, ale w kilku % przypadków może dojść do wystąpienia gorączki powyżej 39°C, zropienia węzłów chłonnych i błędnego rozpoznania takich objawów, gdzie wykwity skórne mylone są z wykwitami ospy wietrznej.
Bartonella może atakować wiele układów i narządów - infekcyjne zapalenie wsierdzia (1-15% u ludzi, w tym 85% przypadków to mężczyźni) oraz zapalenie mięśnia sercowego.
Najczęściej zakażeniu Bartonella spp. ulegają zastawki aortalne, odnotowano u 9% pacjentów infekcje sztucznych zastawek. Prawdopodobnie Bartonella henselae odpowiedzialna jest za choroby oczu - ogniskowe zapalenie naczyń siatkówki lub naczyniówki i nerwu wzrokowego, zapalenie błony naczyniowej przedniego odcinka oka, zapalenie w obrębie ciałka szklistego oraz bakteriemie.
Na ryzyko zachorowania na zapalenie wsierdzia wywołane przez Bartonella spp. są bezdomni alkoholicy, gdyż oni narażeni są na większy kontakt ze wszami.
Diagnostyka mikrobiologiczna
Posiewy krwi w przypadku izolacji bakterii Bartonella spp. zwykle są ujemne.
Ponieważ zakażenia przenoszone przez wszy, roztocza (kleszcze) mogą być przyczyną poważnych chorób serca, diagnostyka zakażeń Bartonella powinna być przeprowadzona w każdym przypadku infekcyjnego zapalenia wsierdzia z ujemnym posiewem krwi.
W przypadku powiększonych węzłów chłonnych wskazane jest badanie w kierunku Bartonella spp.
Najbardziej wiarygodnym badaniem diagnostycznym jest metoda serologiczna, gdzie wykrywa się swoiste p/ciała techniką immunofluorescencji pośredniej. Diagnostyka immunologiczna zakażeń B. henselae oparta jest na oznaczaniu p/ciał w klasie IgM i IgG. Przeciwciała mają swoistość rodzajową, zaś w klasie IgM swoistość gatunkową.
Do identyfikacji zakażenia pobierany jest wycinek powiększonego węzła chłonnego na badania histopatologiczne lub oznaczany jest DNA Bartonella sp. metodą PCR. W przypadku zapalenia wsierdzia oznaczamy PCR ze świeżo usuniętych zastawek.
Badanie PCR można robić w trakcie antybiotykoterapii.
Bartonella henselae w badaniach in vitro wykazuje wrażliwość na wiele antybiotyków, w tym na β-laktamy, głównie tetracykliny, fluorochinolony i rifampicyna.
Leczenie bartonelloz przy zakażenia serca nie zawsze jest skuteczne, często prowadzi to konieczności przeszczepiania serca. Leczenie polega na podaniu 2 lub 3 antybiotyków jednocześnie.
Literatura:
Postępy Mikrobiologii. 2012, 1, 37-45
Postępy Mikrobiologii. 2012, 1, 47-53
http://www.cdc.gov/healthypets/diseases/catscratch.htm
Bartonella jest odpowiedzialna za największą liczbę przypadków bartonelloz występujących na całym świecie. Bartonella spp. to bakterie wewnątrzkomórkowe, wykazujące tropizm do erytrocytów oraz komórek nabłonka naczyń krwionośnych.
Rezerwuarem mogą być zwierzęta domowe oraz dzikie. Mogą być sarny, wiewiórki ziemne, kangury, kojoty, króliki, krety, psy oraz koty, szczególnie młode. Bakterie przenoszone są przez pchły, wszy i kleszcze, które żywią się krwią zakażonych ssaków i wykazują ścisłą preferencję dot. przenoszonego gatunku bakterii jak i rezerwuaru.
Podczas I wojny światowej odnotowano ok. 400 000 zachorowań na bartonellozę wśród wojsk Ententy i państw centralnych. Choroba wywołana przez Bartonella quintana zwana gorączką okopową dopadła żołnierzy ze względu na panującą wszawicę (głowową i odzieżową). Ten sam gatunek zaatakował żołnierzy niemieckich na froncie wschodnim w czasie II wojny światowej.
W latach 1940-45 odnotowano przypadki zakażeń laboratoryjnych u karmicieli wszy i pracowników w zakładach produkujących szczepionkę przeciw durowi plamistemu (Rickettsia prowazeki).
Przykładem zoonozy jest choroba kociego pazura z ang. zwaną CSD (cat scratch disease). Wywołują ją gatunki Bartonella henselae i Bartonella clarridgeide, 2 z 24 poznanych gatunków z rodzaju Bartonella należące do rzędu Rickettsiales. Wektorem Bartonella henselae i Bartonella clarridgeide są przede wszystkim pchły kocie. Kontakt z ich odchodami powoduje przeniesienie bakterii na inne zwierzęta, na uszkodzoną skórę człowieka powodując zakażenie. Podobnie zakażenie występuje przez ślinę psów zwłaszcza bezdomnych i kotów.
Choroba kociego pazura ma zazwyczaj przebieg łagodny, ale w kilku % przypadków może dojść do wystąpienia gorączki powyżej 39°C, zropienia węzłów chłonnych i błędnego rozpoznania takich objawów, gdzie wykwity skórne mylone są z wykwitami ospy wietrznej.
Bartonella może atakować wiele układów i narządów - infekcyjne zapalenie wsierdzia (1-15% u ludzi, w tym 85% przypadków to mężczyźni) oraz zapalenie mięśnia sercowego.
Najczęściej zakażeniu Bartonella spp. ulegają zastawki aortalne, odnotowano u 9% pacjentów infekcje sztucznych zastawek. Prawdopodobnie Bartonella henselae odpowiedzialna jest za choroby oczu - ogniskowe zapalenie naczyń siatkówki lub naczyniówki i nerwu wzrokowego, zapalenie błony naczyniowej przedniego odcinka oka, zapalenie w obrębie ciałka szklistego oraz bakteriemie.
Na ryzyko zachorowania na zapalenie wsierdzia wywołane przez Bartonella spp. są bezdomni alkoholicy, gdyż oni narażeni są na większy kontakt ze wszami.
Diagnostyka mikrobiologiczna
Posiewy krwi w przypadku izolacji bakterii Bartonella spp. zwykle są ujemne.
Ponieważ zakażenia przenoszone przez wszy, roztocza (kleszcze) mogą być przyczyną poważnych chorób serca, diagnostyka zakażeń Bartonella powinna być przeprowadzona w każdym przypadku infekcyjnego zapalenia wsierdzia z ujemnym posiewem krwi.
W przypadku powiększonych węzłów chłonnych wskazane jest badanie w kierunku Bartonella spp.
Najbardziej wiarygodnym badaniem diagnostycznym jest metoda serologiczna, gdzie wykrywa się swoiste p/ciała techniką immunofluorescencji pośredniej. Diagnostyka immunologiczna zakażeń B. henselae oparta jest na oznaczaniu p/ciał w klasie IgM i IgG. Przeciwciała mają swoistość rodzajową, zaś w klasie IgM swoistość gatunkową.
Do identyfikacji zakażenia pobierany jest wycinek powiększonego węzła chłonnego na badania histopatologiczne lub oznaczany jest DNA Bartonella sp. metodą PCR. W przypadku zapalenia wsierdzia oznaczamy PCR ze świeżo usuniętych zastawek.
Badanie PCR można robić w trakcie antybiotykoterapii.
Można również oznaczać markery, które pozwalają na genotypowanie, identyfikację gatunków, co ma znaczenie w dochodzeniu epidemiologicznym.
Leczenie bartonellozBartonella henselae w badaniach in vitro wykazuje wrażliwość na wiele antybiotyków, w tym na β-laktamy, głównie tetracykliny, fluorochinolony i rifampicyna.
Leczenie bartonelloz przy zakażenia serca nie zawsze jest skuteczne, często prowadzi to konieczności przeszczepiania serca. Leczenie polega na podaniu 2 lub 3 antybiotyków jednocześnie.
Literatura:
Postępy Mikrobiologii. 2012, 1, 37-45
Postępy Mikrobiologii. 2012, 1, 47-53
http://www.cdc.gov/healthypets/diseases/catscratch.htm
piątek, 8 czerwca 2012
EAEC
EAEC to enteroagregacyjne szczepy pałeczek Escherichia coli należące do grupy biegunkotwórczych pałeczek E. coli, wywołujących biegunki u dzieci i dorosłych. Biorą udział w wywoływaniu tzw. biegunek podróżnych.
W Polsce EAEC nie stanowią problemu epidemiologicznego, ale głównie dlatego, że są trudne do zdiagnozowania, więc nieznane są faktyczne ilości zachorowań z powodu zakażeń EAEC. Biochemicznie nie różnią się od innych niepatogennych E. coli. Duże zróżnicowanie serologiczne EAEC dodatkowo utrudnia ich identyfikację.
Pierwsze doniesienia na temat biegunki wywołanej przez EAEC pochodzą z lat 80. XX w.
EAEC odpowiadają przede wszystkim za wodnistą biegunkę z dużą ilością śluzu utrzymującą się 2-3 tygodnie.Zdarza się, że biegunka może mieć przebieg ostry, z towarzyszącymi wymiotami, podwyższoną temperaturą i domieszką krwi w kale.Okres wylęgania 8-18 godzin.
Najważniejszą cechą wirulencji EAEC jest ich zdolność do adhezji, czyli ścisłego przylegania jelita i tworzenie biofilmu z dużą ilością śluzu, dzięki obecności mannozoopornych fimbrii adhezyjnych (AAF). Fimbrie kodowane są przez plazmidy aggA, aafA, agg-3A. To znacznie upośledza wchłanianie wody i składników odżywczych.
W tworzeniu biofilmu odgrywa rolę białko dyspersyna, kodowane przez gen aap.
Szczepy EAEC wytwarzają toksynę ciepłostałą EAST-1, toksynę Pet (białko o właściwościach enterotoksyny) oraz toksynę ShET1. Wszystkie toksyny kodowane są na plazmidzie.
Dużym zagrożeniem dla człowieka sa szczepy 'hybrydowe', czyli posiadające wspólne dla różnych typów patogennych E. coli. Największe niebezpieczeństwo niesie nabycie przez szczep EAEC - DNA bakteriofaga charakterystycznego dla VTEC (werotoksyczny szczep E. coli). Szczep taki może wywoływać zespół hemolityczno-mocznicowy (HUS).
---------------
Źródło: Medycyna Doświadczalna i Mikrobiologia. Zeszyt 1/2012, 64: 63-71
W Polsce EAEC nie stanowią problemu epidemiologicznego, ale głównie dlatego, że są trudne do zdiagnozowania, więc nieznane są faktyczne ilości zachorowań z powodu zakażeń EAEC. Biochemicznie nie różnią się od innych niepatogennych E. coli. Duże zróżnicowanie serologiczne EAEC dodatkowo utrudnia ich identyfikację.
Pierwsze doniesienia na temat biegunki wywołanej przez EAEC pochodzą z lat 80. XX w.
EAEC odpowiadają przede wszystkim za wodnistą biegunkę z dużą ilością śluzu utrzymującą się 2-3 tygodnie.Zdarza się, że biegunka może mieć przebieg ostry, z towarzyszącymi wymiotami, podwyższoną temperaturą i domieszką krwi w kale.Okres wylęgania 8-18 godzin.
Najważniejszą cechą wirulencji EAEC jest ich zdolność do adhezji, czyli ścisłego przylegania jelita i tworzenie biofilmu z dużą ilością śluzu, dzięki obecności mannozoopornych fimbrii adhezyjnych (AAF). Fimbrie kodowane są przez plazmidy aggA, aafA, agg-3A. To znacznie upośledza wchłanianie wody i składników odżywczych.
W tworzeniu biofilmu odgrywa rolę białko dyspersyna, kodowane przez gen aap.
Szczepy EAEC wytwarzają toksynę ciepłostałą EAST-1, toksynę Pet (białko o właściwościach enterotoksyny) oraz toksynę ShET1. Wszystkie toksyny kodowane są na plazmidzie.
Dużym zagrożeniem dla człowieka sa szczepy 'hybrydowe', czyli posiadające wspólne dla różnych typów patogennych E. coli. Największe niebezpieczeństwo niesie nabycie przez szczep EAEC - DNA bakteriofaga charakterystycznego dla VTEC (werotoksyczny szczep E. coli). Szczep taki może wywoływać zespół hemolityczno-mocznicowy (HUS).
---------------
Źródło: Medycyna Doświadczalna i Mikrobiologia. Zeszyt 1/2012, 64: 63-71
Etykiety:
AAF,
adhezja,
bakteriofag,
biegunki,
Biegunkotwórcze pałeczki E. coli,
biofilm,
Diagnostyka Mikrobiologiczna,
E. coli,
EAEC,
fimbrie,
HUS,
Pet,
plazmidy,
ShET1,
VTEC,
wirulencja
Biegunkotwórcze pałeczki E. coli
Istnieje
dość duży odsetek zachorowania na
biegunki zarówno u dzieci, jak i dorosłej populacji o nieustalonym czynniku etiologicznym.
Jeżeli więc w próbce kału nie wyhodowano żadnych
chorobotwórczych drobnoustrojów, nie oznacza to, że nie ma wskazań do
zaniechania leczenia oraz, że nie ma problemu epidemiologicznego.
Uzyskanie
precyzyjnego wyniku badania zależy w
dużej mierze od dobrej diagnostyki mikrobiologicznej, w tym od wachlarzu badań.
W większości krajów europejskich prowadzi się szerszy zakres badań
diagnostycznych, niż u nas w Polsce. U nas ten zakres badań jest ograniczony, z powodu braku przydatnych diagnostycznych markerów, ale głównie ze względów ekonomicznych.
Przykładem
może być właśnie diagnostyka schorzeń przewodu pokarmowego i zatruć pokarmowych, w tym wachlarz
badań pałeczki okrężnicy Escherichia coli, odpowiedzialnej w
dużym stopniu za owe schorzenia.
Pałeczki
E. coli należą do fizjologicznej flory jelitowej i wyhodowanie jej z kału od
osoby z biegunką bez oceny chorobotwórczości izolowanego szczepu nie może być
podstawą do uznania go za czynnik etiologiczny.
Patogenne
dla przewodu pokarmowego człowieka szczepy E. coli podzielono na kilka
kategorii zależnie od obecności genotypowych lub genotypowych markerów
chorobotwórczości:
- EPEC - enteropatogenne pałeczki E. coli
- VTEC - werotoksyczne szczepy pałeczek E. coli
- EIEC - enteroinwazyjne pałeczki E. coli
- ETEC- enterotoksynogenne pałeczki E. coli
- EAEC - EAEC enteroagregacyjne pałeczki E. coli
- DAEC - przylegające dyfuzyjnie pałeczki E. coli
- AIEC - adherentno- inwazyjne pałeczki E. coli
- CDEC - pałeczki E. coli zdolne do odrywania komórek od podłoża, na którym rosną
zobacz Słowniczek Mikrobiologiczny
środa, 14 marca 2012
Zdrowie na giełdzie
Kilka tygodni temu mieszkańców 70 tysięcznej populacji leżajskiej ogarnął strach i panika przed perspektywą braku dostępności do mikrobiologicznych badań diagnostycznych.
Wojewódzki Inspektor Sanitarny w Rzeszowie ogłosił likwidację 11 laboratoriów w sanepidach, w tym laboratorium mikrobiologicznego PSSE w Leżajsku.
Zadania, jakie należą do medycznego laboratorium mikrobiologicznego dają mieszkańcom poczucie bezpieczeństwa w sytuacjach zagrożenia zdrowotnego, sanitarnego, epidemiologicznego, klęsk żywiołowych.
Jakie oszczędności miałaby przynieść budżetowi państwa likwidacja laboratorium? Uzdrowić służbę zdrowia? Poprawić sytuację sanitarno-epidemiologiczną?
A może chodzi o lobbowanie na rzecz komercji i przygotowywanie gruntu pod interes prywatnych przedsięwzięć? Diagnostyka medyczna jest bardzo atrakcyjną niszą do zagospodarowania i zrewolucjonizowania rynku medycznego. Na diagnostyce medycznej można nieźle zarobić. Certyfikowane laboratoria, wykształcony personel to kapitał wart zachodu.
Wojewódzki Inspektor Sanitarny w Rzeszowie ogłosił likwidację 11 laboratoriów w sanepidach, w tym laboratorium mikrobiologicznego PSSE w Leżajsku.
Zadania, jakie należą do medycznego laboratorium mikrobiologicznego dają mieszkańcom poczucie bezpieczeństwa w sytuacjach zagrożenia zdrowotnego, sanitarnego, epidemiologicznego, klęsk żywiołowych.
Jakie oszczędności miałaby przynieść budżetowi państwa likwidacja laboratorium? Uzdrowić służbę zdrowia? Poprawić sytuację sanitarno-epidemiologiczną?
A może chodzi o lobbowanie na rzecz komercji i przygotowywanie gruntu pod interes prywatnych przedsięwzięć? Diagnostyka medyczna jest bardzo atrakcyjną niszą do zagospodarowania i zrewolucjonizowania rynku medycznego. Na diagnostyce medycznej można nieźle zarobić. Certyfikowane laboratoria, wykształcony personel to kapitał wart zachodu.
Nad Wisłą wciąż nie docenia się diagnostyki medycznej i oszczędza się na niej, zamiast w nią inwestować - uważa Tomasz Tuora 36-letni biznesmen z Łomianek, który chce opatentować i wprowadzić na światowy rynek polski analizator krwi.
 |
| Biznes w kropli krwi |
Miłosz Węglewski w artykule 'Biznes w kropli krwi' w Newsweeku Nr 9/2012 opisuje mechanizm, w jaki sposób przygotowuje się grunt pod taki biznes.
Oto fragmenty artykułu:
(..) Wprowadzenie na rynek naszego analizatora będzie podobnym przełomem w diagnostyce jak pojawienie się glukometru 40 lat temu – zapowiada Tomasz Tuora, prezes i główny akcjonariusz Cormaya.
Nie słyszeliście o nim? Nic dziwnego. Jego przodkowie pochodzą ze Szwajcarii, a nad Wisłą znają go głównie ludzie z branży medycznej i farmaceutycznej, no i paruset inwestorów giełdowych. Zwłaszcza tych, którzy trzy lata temu mieli intuicję albo szczęście i kupili akcje spółki Cormay po 1-2 zł albo rok temu po niespełna 6 zł. Dziś kosztują one prawie 16 zł i w latach kryzysu okazały się najlepszą inwestycją na warszawskiej giełdzie. Ba, ulokowanie pieniędzy w akcjach tego tygrysa branży medycznej i biotechnologicznej, wycenianego przez rynek na prawie pół miliarda złotych, było korzystniejsze niż zakup srebra czy złota. To właśnie dzięki entuzjazmowi inwestorów 36-letni biznesmen z Łomianek już w przyszłym roku może wejść do pierwszej setki najbogatszych Polaków.
Trampoliną do wejścia Cormaya na największy rynek diagnostyki medycznej ma być przejęcie notowanej na giełdzie Nasdaq firmy o podobnym profilu, mającej przetarte kanały dystrybucji.
Giełda, tak jak branża medyczna, jest pod wrażeniem dotychczasowej skuteczności Tuory w budowaniu biznesu o zasięgu globalnym przez starannie przemyślane, precyzyjnie przeprowadzane i efektywne przejęcia zagranicznych spółek.
Bo jego największą pasją i atutem jest zarządzanie: pieniędzmi, ludźmi, projektami. Gdyby los nie związał go akurat z tą branżą, byłby zapewne równie sprawnym menedżerem w transporcie, przemyśle spożywczym czy budownictwie. Szukałby tam atrakcyjnych nisz i pomysłów, które mogą je zrewolucjonizować.Jednak nie chodzi mu o samą rewolucję, tylko o zarobienie na niej.
wtorek, 31 stycznia 2012
Test Goulda. Badanie bakteriurii
Zakażenia
układu moczowego (ZUM) stanowią poważny problem diagnostyczny, terapeutyczny i
epidemiologiczny.
Szybkie podanie antybiotyku w przypadku ZUM jest co prawda zasadne i wielu klinicystów podejmuje się leczenia bez uprzednich badań mikrobiologicznych, jednak wskazane jest zlecenia badania bakteriurii, jeszcze przed włączeniem antybiotykoterapii, celem ustalenia czynnika etiologicznego oraz określenia wrażliwości na antybiotyki i chemioterapeutyki.
Hodowla, w której albo nie stwierdza się wzrostu w ciągu 24 lub 48 godzin lub wzrost jest mniejszy niż 10 000 CFU/ml, zwykle świadczy, że nie ma zakażenia. Jeżeli jednak objawy utrzymują się posiew powinien być powtórzony.
Bakteriomocz poniżej 1000 komórek/1ml (103CFU/ml) uważa się za bakteriurię nieznamienną. Wyjątkiem są wyhodowane w moczu pałeczki ropy błękitnej Pseudomonas aeruginosa, których obecność niezależnie od liczby bakterii, świadczy o ZUM.
Szybkie podanie antybiotyku w przypadku ZUM jest co prawda zasadne i wielu klinicystów podejmuje się leczenia bez uprzednich badań mikrobiologicznych, jednak wskazane jest zlecenia badania bakteriurii, jeszcze przed włączeniem antybiotykoterapii, celem ustalenia czynnika etiologicznego oraz określenia wrażliwości na antybiotyki i chemioterapeutyki.
Bakteriologiczne badanie moczu w trakcie antybiotykoterapii ogranicza wartość wyniku mikrobiologicznego.
Podczas badania bakteriurii należy koniecznie wykonać test Goulda, by sprawdzić i określić czy w badanej próbce moczu znajdują się czynniki zahamowania wzrostu dla bakterii Gram (+) i Gram (-). Ma to istotne znaczenie dla prawidłowej interpretacji wyniku, gdy wynik jest ujemny lub wątpliwy.
W tym celu na podłoże Mueller-Hintona posiewamy 2 szczepy wzorcowe: Staphylococcus aureus ATCC 25923 będącym przedstawicielem bakterii Gram-dodatnich i Escherichia coli ATCC 25922 będącym przedstawicielem bakterii Gram-ujemnych, po czym nakładamy krążek bibułowy nasączony w badanej próbce moczu uprzednio ogrzanej przez 60 min. w temp. 60 ° C. Za wynik dodatni, świadczący o obecności w moczu czynnika hamującego wzrost bakterii, przyjmuje się każdą strefę zahamowania wzrostu szczepów wzorcowych wokół krążka. Gdy jeden lub obydwa czynniki są dodatnie należy badanie powtórzyć, gdyż po ustąpieniu czynnika hamującego wzrost może nastąpić wzrost bakterii.
Nie można określić czynników zahamowania wzrostu dla bakterii Gram (+) i Gram (-) przesyłając do badania mocz na dostępnych na rynku URICULTACH, stosowanych dość powszechnie przez pacjentów. Uriculty uniemożliwiają określenie ilościowo, a jedynie orientacyjnie jednostek CFU na 1ml moczu. Uriculty nie pozwalają na prawidłową diagnostykę.
W tym celu na podłoże Mueller-Hintona posiewamy 2 szczepy wzorcowe: Staphylococcus aureus ATCC 25923 będącym przedstawicielem bakterii Gram-dodatnich i Escherichia coli ATCC 25922 będącym przedstawicielem bakterii Gram-ujemnych, po czym nakładamy krążek bibułowy nasączony w badanej próbce moczu uprzednio ogrzanej przez 60 min. w temp. 60 ° C. Za wynik dodatni, świadczący o obecności w moczu czynnika hamującego wzrost bakterii, przyjmuje się każdą strefę zahamowania wzrostu szczepów wzorcowych wokół krążka. Gdy jeden lub obydwa czynniki są dodatnie należy badanie powtórzyć, gdyż po ustąpieniu czynnika hamującego wzrost może nastąpić wzrost bakterii.
Nie można określić czynników zahamowania wzrostu dla bakterii Gram (+) i Gram (-) przesyłając do badania mocz na dostępnych na rynku URICULTACH, stosowanych dość powszechnie przez pacjentów. Uriculty uniemożliwiają określenie ilościowo, a jedynie orientacyjnie jednostek CFU na 1ml moczu. Uriculty nie pozwalają na prawidłową diagnostykę.
Bakteriologiczne
ilościowe badania moczu zostały zapoczątkowane przez Kassa. Mają one ogromną
wartość diagnostyczną, rozstrzygają, czy fakt wyizolowania bakterii z moczu
rzeczywiście wskazuje na proces infekcyjny toczący się w układzie moczowym czy
też bakterie te stanowią nieistotne zanieczyszczenie próbki moczu.[1]
Powszechne stosowanie antybiotyków sprzyja selekcji szczepów wrażliwych na antybiotyki. Coraz częściej pojawiają się szczepy wytwarzające różnorodne mechanizmy oporności na antybiotyki.
Obecność znamiennej liczby bakterii jednego rodzaju świadczy o zakażeniu. Przyjmuje się, że jeśli w posiewie wyhodujemy więcej niż 10 000 jednostek tworzących kolonie (CFU/ml) to uznajemy bakteriurię znamienną oznaczającą obecność bakterii w moczu. Przeprowadza się wtedy oznaczenie antybiotykowrażliwości, aby ustalić schemat leczenia.
Powszechne stosowanie antybiotyków sprzyja selekcji szczepów wrażliwych na antybiotyki. Coraz częściej pojawiają się szczepy wytwarzające różnorodne mechanizmy oporności na antybiotyki.
Obecność znamiennej liczby bakterii jednego rodzaju świadczy o zakażeniu. Przyjmuje się, że jeśli w posiewie wyhodujemy więcej niż 10 000 jednostek tworzących kolonie (CFU/ml) to uznajemy bakteriurię znamienną oznaczającą obecność bakterii w moczu. Przeprowadza się wtedy oznaczenie antybiotykowrażliwości, aby ustalić schemat leczenia.
Hodowla, w której albo nie stwierdza się wzrostu w ciągu 24 lub 48 godzin lub wzrost jest mniejszy niż 10 000 CFU/ml, zwykle świadczy, że nie ma zakażenia. Jeżeli jednak objawy utrzymują się posiew powinien być powtórzony.
Bakteriomocz poniżej 1000 komórek/1ml (103CFU/ml) uważa się za bakteriurię nieznamienną. Wyjątkiem są wyhodowane w moczu pałeczki ropy błękitnej Pseudomonas aeruginosa, których obecność niezależnie od liczby bakterii, świadczy o ZUM.
Na
liczbę wykrywanych jednostek CFU w 1 mililitrze badanego moczu wpływa szereg
czynników, takich jak obecność leków, antybiotyków i in. związków hamujących
wzrost drobnoustrojów, ale także pH moczu itp.
Dostępne na rynku testy paskowe dają co prawda możliwość szybkiej, wstępnej weryfikacji zakażenia układu moczowego. Pamiętać jednak należy, że mają one jedynie wartość orientacyjną, mogą dawać fałszywie dodatnie wyniki w przypadku zażywania niektórych antybiotyków np. cefaleksyny, tetracykliny, a także w przypadku występowania dużej oksalurii lub glukozurii, ponadto krwiomocz makroskopowy charakterystyczny dla etiologii wirusowej powoduje odbarwienie testu.
Dostępne na rynku testy paskowe dają co prawda możliwość szybkiej, wstępnej weryfikacji zakażenia układu moczowego. Pamiętać jednak należy, że mają one jedynie wartość orientacyjną, mogą dawać fałszywie dodatnie wyniki w przypadku zażywania niektórych antybiotyków np. cefaleksyny, tetracykliny, a także w przypadku występowania dużej oksalurii lub glukozurii, ponadto krwiomocz makroskopowy charakterystyczny dla etiologii wirusowej powoduje odbarwienie testu.
[1] Wybrane zagadnienia z
zakresu laboratoryjnej diagnostyki. Akademia Medyczna w Krakowie. 1979.
środa, 18 stycznia 2012
Udział plazmidów i bakteriofagów w tworzeniu różnorodnych typów serologicznych Salmonella
W kolekcji szczepów własnych, jakie udało się nam wyhodować w
laboratorium mikrobiologicznym mamy zgromadzonych ok. 20 szczepów pałeczek Salmonella należących do
różnych grup serologicznych. Szczepy wyhodowano z materiału od chorych na
schorzenia żołądkowo-jelitowe, osób ze styczności, od nosicieli SS (np. S. Paratyphi B od nosiciela stałego) lub z
materiału przesłanego do identyfikacji z innych laboratoriów mikrobiologicznych.
S. Newport – 6,8,20:e,h:1,2:[z67]
Skąd taka różnorodność antygenowa szczepów, wśród jednego tylko podgatunku enterica? Skąd takie egzotycznie brzmiące nazwy serotypów?
W Schemacie White’a-Kauffmanna-Le Minora znalazłam zaledwie jeden nowy serowar wykryty po raz pierwszy w Polsce. Nazwany Salmonella Lodz, zapewne z tego powodu, że został wykryty w Łodzi, bo taka jest konwencja, aby nowo wykryty, dotychczas nieznany szczep nazwać nazwą miejscowości, w której został wykryty.
Ewolucja w świecie żywym trwa, więc kto wie, może kiedyś?!
Zmienność w świecie organizmów prokariotycznych jest wynikiem wymiany genetycznej zakodowanej w chromosomach i innych elementach genetycznych, jak plazmidach czy profagach odgrywa istotną rolę w ewolucji. Pełnią one bardzo ważną rolę w kształtowaniu nowych wariantów tych mikroorganizmów.
Źródło:
Pałeczki z rodzaju Salmonella liczą ogółem 2557 typów serologicznych, z czego gatunek Salmonella enterica subsp. enterica liczy 1531 typów serologicznych. W ciągu 30 lat mojej pracy udało mi się wykryć, oznaczyć i zgromadzić conajmniej 20 serowarów z różnych grup serologicznych. Każdy z nich (oprócz S. Enteritidis -najczęściej występujący na naszym terenie) został potwierdzony przez laboratorium referencyjne wojewódzkiej stacji, bądź w PZH lub Krajowym Ośrodku Salmonella.
Serologiczne typy pałeczek z rodzaju Salmonella wyhodowane w latach 1980-2011 w laboratorium PSSE w Leżajsku
Typ serologiczny - Antygen 0: Antygen H Faza 1: Antygen H Faza2
S. Schleissheim – 4,12,27:b
S. Schleissheim – 4,12,27:b
S. Paratyphi B
- 1,4,[5],12,27:b:1,2
S. Abony II - 1,4,12,27:b:e,n,x
S. Derby - 1,4,[5],12:f.g:[1,2]
S. Agona - 1,4,12:f,g,s:[1,2]
S. Typhimurium - 1,4,[5],12:i:1,2
S. Lagos - 1,4,[5],12:l:1,5
S. Heidelberg – 1,4,[5],12:r:[1,2]
S. Infantis – 6,7,14:r:1,5
S. Montevideo – 6,7,14:g,m,[p],s:[1,2,7]
S. Oranienburg –
6,7,14:m,t:[z57]
S. Mbandaka – 6,7,14:z10:e,n,z15
S. Virchow – 6,7,14:r:1,2
S. Tennessee – 6,7,14:z29:[1,2,7]
S. Tennessee – 6,7,14:z29:[1,2,7]
S. Hadar – 6,8:z10:e,n,x
S. Enteritidis – 1,9,12:g,m
S. Javiana – 1,9,12:l,z28:1,5
S. Anatum – 3,10[15] [15,34]:e,h:1,6
S. Muenster – 3,10[15] [15,34]:e,h:1,5
Objaśnienia:
[ ] = antygen 0 lub H, bądź ich składniki mogą nie występować
cyfra podkreślona = składniki 0 antygenu ujawniające się dopiero w następstwie konwersji fagowej, mogą wystepować wtedy, gdy hodowla bakteryjna ulegnie lizogenizacji przez odpowiedniego faga.
S. Muenster – 3,10[15] [15,34]:e,h:1,5
Objaśnienia:
[ ] = antygen 0 lub H, bądź ich składniki mogą nie występować
cyfra podkreślona = składniki 0 antygenu ujawniające się dopiero w następstwie konwersji fagowej, mogą wystepować wtedy, gdy hodowla bakteryjna ulegnie lizogenizacji przez odpowiedniego faga.
Skąd taka różnorodność antygenowa szczepów, wśród jednego tylko podgatunku enterica? Skąd takie egzotycznie brzmiące nazwy serotypów?
W Schemacie White’a-Kauffmanna-Le Minora znalazłam zaledwie jeden nowy serowar wykryty po raz pierwszy w Polsce. Nazwany Salmonella Lodz, zapewne z tego powodu, że został wykryty w Łodzi, bo taka jest konwencja, aby nowo wykryty, dotychczas nieznany szczep nazwać nazwą miejscowości, w której został wykryty.
Mam nadzieję, że uda mi się kiedyś wyhodować szczep, o całkiem
nowym dotychczas jeszcze nieznanym zestawie antygenów, że Instytut
Pasteura potwierdzi jego przynależność do Salmonella enterica subsp. enterica, że zostanie on umieszczony w Schemacie White’a-Kauffmanna-Le Minora, dokumencie referencyjnym
przeznaczonym do identyfikacji serologicznej bakterii Salmonella, w którym figurować
będzie jako serotyp o nazwie Salmonella Lezajsk.
Ewolucja w świecie żywym trwa, więc kto wie, może kiedyś?!
Zmienność w świecie organizmów prokariotycznych jest wynikiem wymiany genetycznej zakodowanej w chromosomach i innych elementach genetycznych, jak plazmidach czy profagach odgrywa istotną rolę w ewolucji. Pełnią one bardzo ważną rolę w kształtowaniu nowych wariantów tych mikroorganizmów.
Taka wymiana informacji genetycznej zachodzi pomiędzy
komórkami nawet odległych filogenetycznie gatunków bakterii.
Na przykład, spośród 173 przebadanych szczepów Salmonella Typhimurium, aż 136 zawierało
profagi. Badania prowadzone z zastosowaniem takich metod jak hybrydyzacja
DNA oraz analiza porównawcza sekwencji
DNA genomów Salmonella Typhi i Salmonella Typhimurium wykazały, że to
głównie zawartość genów pochodzących z plazmidów typu F i lambdoidalnych
fagów decyduje o różnorodności obserwowanej pomiędzy tymi serowarami [1].
O różnorodności między serowarami decydują w dużej mierze
geny zlokalizowane na plazmidach typu F i lamdoidalnych fagach.
Plazmid koniugacyjny F, charakterystyczny dla E. coli,
może być przekazywany w procesie koniugacji z E. coli do
S. Typhimurium, a także do innych typów serologicznych salmonella.
Izolowano szczepy S. Typhimurium, posiadające plazmid F wbudowany do
chromosomu; szczepy takie nazywane są, podobnie jak u E. coli, szczepami
Hfr (high-frequency of recombination). Istnieje więc możliwość przekazywania
z wysoką częstotliwością genów chromosomowych ze szczepów Hfr S. Typhimurium do szczepów E. coli i odwrotnie. Na przykład geny
chromosomowe odpowiedzialne za syntezę antygenów O, H czy Vi bakterii
salmonella, mogą być przekazywane w procesie koniugacji, wraz z plazmidem
F, bakteriom z rodzaju Escherichia [1].
Więcej >>> Serologiczna identyfikacja Salmonella
Słowniczek i Terminologia
Plazmidy - samodzielne, pozachromosomowe replikony, kodujące takie cechy jak: oporność na antybiotyki i inne leki bakteriobójcze, oporność na jony metali ciężkich, wytwarzanie antybiotyków i bakteriocyn, katabolizm toksycznych związków, zdolność do koniugacji, fermentacji laktozy, pigmentacji i inne właściwości.
Geny umiejscowione na plazmidach mogą również warunkować patogenność bakterii względem człowieka i zwierząt
Istnieje wiele różnych plazmidów, między innymi: plazmidy typu R (opornościowe), typu F (konigacyjne), plazmidy kolicynowe, degradacyjne i plazmidy wirulencji.
Niektóre plazmidy integrują się z chromosomem bakteryjnym i ulegają kopiowaniu w tym samym czasie co chromosom gospodarza. Ta zintegrowana forma plazmidu zwanego episomem, może przejść wiele podziałów komórkowych zanim plazmid ponownie oddzieli się od chromosomu.
Słowniczek i Terminologia
Plazmidy - samodzielne, pozachromosomowe replikony, kodujące takie cechy jak: oporność na antybiotyki i inne leki bakteriobójcze, oporność na jony metali ciężkich, wytwarzanie antybiotyków i bakteriocyn, katabolizm toksycznych związków, zdolność do koniugacji, fermentacji laktozy, pigmentacji i inne właściwości.
Geny umiejscowione na plazmidach mogą również warunkować patogenność bakterii względem człowieka i zwierząt
Należą do nich, między innym, geny kodujące zdolność
patogenu do adhezji do powierzchni odpowiednich komórek u zakażonego gospodarza, penetracji do wnętrza komórki, zdolność do produkcji różnych
toksyn, oporność na bakteriobójcze działanie czynników występujących w
surowicy i inne.
Istnieje wiele różnych plazmidów, między innymi: plazmidy typu R (opornościowe), typu F (konigacyjne), plazmidy kolicynowe, degradacyjne i plazmidy wirulencji.
Niektóre plazmidy integrują się z chromosomem bakteryjnym i ulegają kopiowaniu w tym samym czasie co chromosom gospodarza. Ta zintegrowana forma plazmidu zwanego episomem, może przejść wiele podziałów komórkowych zanim plazmid ponownie oddzieli się od chromosomu.
1. POST. MIKROBIOL., 2011, 50, 3, 201–208. Plazmidy i bakteriofagi występujące u Salmonella
2. Etiologia, obraz kliniczny i diagnostyka ostrych zakażeń i zarażeń przewodu pokarmowego oraz zatruć pokarmowych pod red. Marka Jagielskiego. Warszawa 2010
2. Etiologia, obraz kliniczny i diagnostyka ostrych zakażeń i zarażeń przewodu pokarmowego oraz zatruć pokarmowych pod red. Marka Jagielskiego. Warszawa 2010
poniedziałek, 12 grudnia 2011
Moraxella catarrhalis - diagnostyka mikrobiologiczna
Zjawisko patogenności pośredniej w anginie paciorkowcowej polega na równoczesnej obecności w górnych drogach oddechowych paciorkowca i bakterii wytwarzających ß-laktamazy.Bakterie te, nie będąc bezpośrednią przyczyną stanu zapalnego, chronią paciorkowce przed bakteriobójczym działaniem penicyliny i innych antybiotyków ß-laktamowych, powodując ich rozkład w miejscu zakażenia. Kopatogenami są zwykle bakterie stanowiące florę fizjologiczną gardła lub potencjalne patogeny u nosicieli. Należą do nich Staphylococcus aureus, pałeczki Moraxella catarhalis i Haemophilus influenzae oraz beztlenowce takie jak Peptostreptococcus melaninogenica, Bacteroides oralis, Fusobacterium sp.
Odsetek pałeczek Moraxella catarrhalis wytwarzających ß-laktamazy typu BRO-1 i BRO-2 rozkładających penicylinę i aminopenicyliny wynosi obecnie w Polsce ponad 80%. Dwoinki ß-laktamazododatnie są nadal wrażliwe na amoksycylinę z inhibitorem, cefalosporyny II (cefuroksym) i III generacji, makrolidy, kotrimoksazol, doksycyklinę, fluorochinolony.
Moraxella catarrhalis na agarze z dodatkiem 5% krwi baraniej, rosną jako białe, drobne, nie hemolizujące kolonie, łatwo przesuwające się po podłożu.
Wybarwiony szczep na niebiesko-
Literatura:
Odsetek pałeczek Moraxella catarrhalis wytwarzających ß-laktamazy typu BRO-1 i BRO-2 rozkładających penicylinę i aminopenicyliny wynosi obecnie w Polsce ponad 80%. Dwoinki ß-laktamazododatnie są nadal wrażliwe na amoksycylinę z inhibitorem, cefalosporyny II (cefuroksym) i III generacji, makrolidy, kotrimoksazol, doksycyklinę, fluorochinolony.
Moraxella catarrhalis na agarze z dodatkiem 5% krwi baraniej, rosną jako białe, drobne, nie hemolizujące kolonie, łatwo przesuwające się po podłożu.
| Moraxella catarrhalis na Columbia agar z dodatkiem 5% krwi baraniej |
Do identyfikacji bakterii oksydazo-dodatnich, a do takich należy Moraxella catarrhalis stosuje się test na oksydazę - tj. test na obecność enzymu z grupy porfiryn - oksydazę cytochromową. Na testowy pasek bibułowy nasączony odpowiednią substancją chemiczną rozprowadzamy masę bakteryjną ezą lub bawełnianą! wymazówką. Po kilkudziesięciu sekundach porównujemy zabarwienie paska bibułowego. Bakterie oksydazo-dodatnie zmieniają bibułę na granatowy kolor.
Do różnicowan
Wybarwiony szczep na niebiesko-
Moraxella catarrhalis - dwoinka Gram (-) oksydazododatnia, katalazododatnia jest trzecią co do częstości (12%) izolowaną bakterią z dróg oddechowych. Bakteria wcześniej nazywana była Neisseria catarrhalis oraz Branhamella catarrhalis. Jest czynnikiem etiologicznym odpowiedzialnym za ostre zapalenie ucha środkowego (10 - 15%), ostre zapalenie zatok, zapalenie gardła i migdałków.
Bakterie Moraxella catarrhalis w większości przypadków stanowi fizjologiczną florę bakteryjną, kolonizując błony śluzowe nosogardzieli nie wywołują żadnych objawów klinicznych, jednak w sprzyjających warunkach mogą uszkadzać sąsiadujące tkanki oraz penetrować do układu krwionośnego i centralnego układu nerwowego. W anginie paciorkowcowej, czynnikiem patogennym jest Streptococcus pyogenes, jednak Moraxella catarrhalis może stać się pośrednim patogenem.
Literatura:
Współczesne standardy rozpoznawania i leczenia zakażeń dróg oddechowych http://medius.com.pl/index.php?PAGE=telegram&TEL_CUR_ID=198&return=archives
Subskrybuj:
Posty (Atom)
.jpg)
.jpg)
.jpg)